33 569 läst · 116 svar
34k läst
116 svar
Propplösare förbjuds 2025
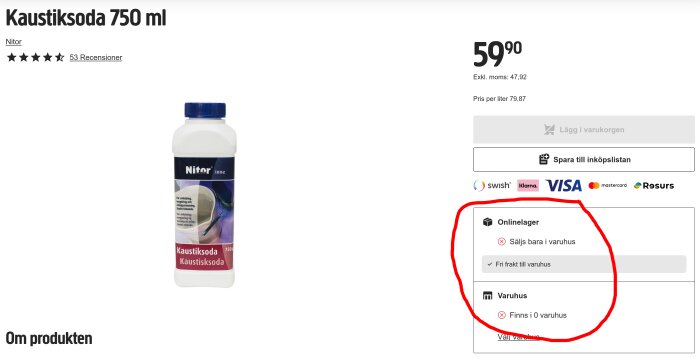
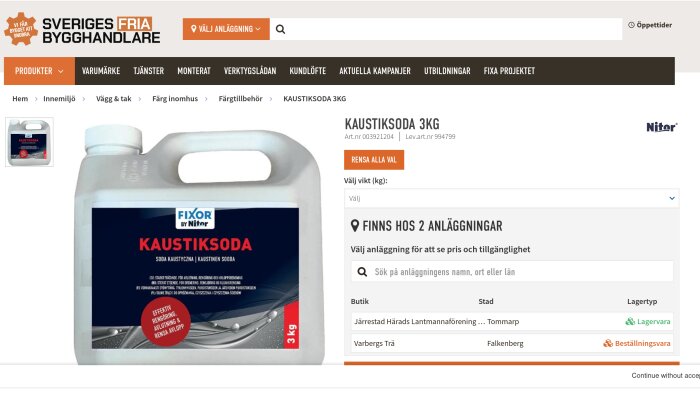
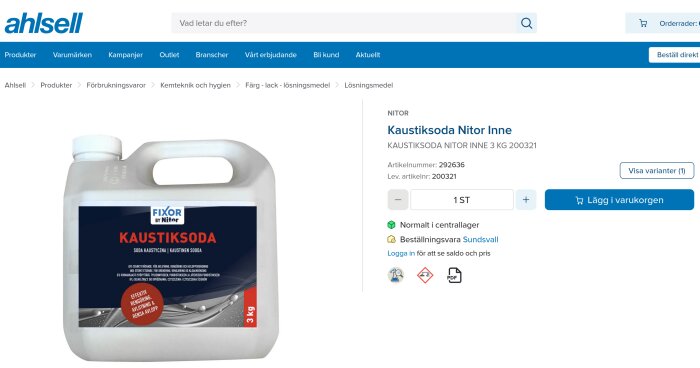
Lite här och där. Jag är för lat för att länka men du hittar nog rätt om någon av butikerna är intressanta. Jag googlade bara på "kaustiksoda 3 kg":Coolman skrev:
Inloggade ser högupplösta bilder
Logga in
Skapa konto
Gratis och tar endast 30 sekunder
Inloggade ser högupplösta bilder
Logga in
Skapa konto
Gratis och tar endast 30 sekunder

Inloggade ser högupplösta bilder
Logga in
Skapa konto
Gratis och tar endast 30 sekunder
Medlem
· Sörmland och stan
· 27 760 inlägg
När jag googlar på "3kg kaustiksoda" får jag upp flera träffar. Men inte alla, bara ett fåtal, vill sända det online.Coolman skrev:
OBS det kommer också upp "Hushållssoda", det är något annat, inte kaustiksoda.
Senast köpte jag det från städshop: https://www.stadshop.se/p/stadkem/rengoringsmedel/grovrengoring-559/kaustiksoda-nitor-3kg.html
Edit: Alfredo, den rackarn, förekom mig.
Diskmedel bikarbonat och citronsyra enkelt billigt och fungerandeJ jahallåja skrev:
Medlem
· Sörmland och stan
· 27 760 inlägg
Om du kokar bikarbonaten så får du en lösning av natriumkarbonat och natriumhydroxid (koldioxiden avgår) och det ger det en fettlösande effekt. Det som staten har velat förbjuda.
Medlem
· Sörmland och stan
· 27 760 inlägg
Lustigt med vår märkliga kemikalielagstiftning att man bara undviker att nämna avlopp på burken så går samma rena kemikalie att sälja. Jaja, vi konsumenter tackar och tar emot.J jahallåja skrev:
Men "hår och slam". Man leker med elden:
Nja, natriumkarbonat blir det förvisso (man kan torr-rosta bikabonat-pulvret också i ugn på typ ett par hundra grader, karaktären på pulvret blir klart annorlunda och mer sandliknande när bikarbonat omvandlas till karbonat - och koldioxid avgår samtidigt) men inte natriumhydroxid.Claes Sörmland skrev:
- för att få natriumhydroxid av natriumsoda måste man till ytterligare trix att blanda med bränd och släkt kalk (CaOH) och då byter karbonatjonerna och hydroxidjonerna plats och karbonatjonerna bildar mycket svårlöslig kalciumkarbonat (även kallad kalk eller krita) som kan sedimenteras ut och det som är kvar är en lösning med natriumhydroxid.
Det var exakt så man gjorde när man skulle luta lutfisken så att den torkade fiskköttet skulle svälla ut igen - natriumsoda eller pottaskan (kaliumkarbonat) hade inte tillräckligt hög pH för att processen skulle starta med svällningen av den torkade fiskköttet.
Att man just förbjöd propplösare som produkt men inte kaustiksoda var just för att minska användningen med att använda kaustiksoda eller kaliumhydroxid för just propplösning i avlopp och i försäljning av dessa i matvaruaffärerna - men man kan eller ville inte förbjuda kaustiksodan (NaOH) som sådan då den har många andra användningsområden som är fullt legala som inom rengöring, pH-reglering (som pool) och hobbys tex. att koka egen tvål mfl.
Själv tycker jag det är OK att just dessa produkter tas ut ur livsmedelsaffärerna och istället 'förvisas' till gubbdagisarna, bygghandel och färghandeln som redan innan hanterar många olika kemiska produkter, men man hade kunnat gjort det redan innan att tex. propplösare inte bör säljas i livsmedelsbutikerna med en förordning och inte ett förbud.
Medlem
· Sörmland och stan
· 27 760 inlägg
Det är ju så här att natriumkarbonat i lösning bildar hydroxidjoner så du får natriumhydroxid i lösning.
Visst det blir hydroxid-joner i soppan med karbonat och/eller vätekarbonat-joner tillsammans med natrium-jonerna, det är det som gör lösningen basisk, men det skulle bli mycket mer basisk med samma mängd natrium om inte karbonat/bikarbonatjonerna var samtidigt i vätskan och surar ned den.
Natriumkarbonat och natriumbikarbonat är ju ett par av kolsyrans salter och eftersom kolsyra är en svagt disocierande syra och kombinerat med stark basisk alkalimetall så blir salterna basisk när det löses i vatten, medans är natrium-jonerna neutraliserad med en stark syra som saltsyra (HCl) så blir saltet neutralt (som koksalt).
Men det går fortfarande inte rena fram ren NaOH ur soda hur mycket man än försöker då när man torkar/kristallicerar ut lösningen så försvinner hydroxid-jonerna då de bara finns som vattenlösning tillsammas med löst natriumkarbonat/bikarbonat...
Men problemet med sodalösning i hur koncentrerad man än gör det så får man inte samma höga pH som överträffas lätt med NaOH löst i vatten även i rätt liten dos.
Med natriumvätekarbonat kommer man inte mycket högre än lite över pH 10 när man har mättad lösning, med natriumsoda i mättad lösning kommer man inte mycket över pH 12 (12.3 ?) - det räcker med knappt 1 gram NaOH i en liter vatten för att nå samma pH som mättad lösning av natriumsoda i pH (har dock inte kontrollräknat)
Vill man ha pH 12.4 och högre, kan man inte använda ovanstående sodalösning även om de är så mycket att en del av sodan fortfarande är olöst i lösningen. För att nå pH 13 räcker det med 4 gram NaOH i en liter vatten, för pH 14 så räcker det med 40 gram NaOH per liter vatten (ger 1 mol OH⁻ per liter) och med 400 gram löst per liter volym så når man runt pH 15 (10 mol OH⁻/liter).
Därav kan man använda utväxlingstekniken med bränd och släkt kalk (CaOH) då karbonatjonerna förenar sig med kalciumet väldigt hårt och fälls ut som kalk/krita och hydroxidjonerna från släkta kalket blir kvar i lösning för natriumjonerna (eller kaliumjonerna om man använder pottaska (kaliumkarbonat)) och pH ökar. Filtrerar man bort fällningen och industar lösningen så blir det till sist fast natriumhydroxid (kaliumhydroxid) på samma sätt som pulvret man köper i affären.
Natriumkarbonat och natriumbikarbonat är ju ett par av kolsyrans salter och eftersom kolsyra är en svagt disocierande syra och kombinerat med stark basisk alkalimetall så blir salterna basisk när det löses i vatten, medans är natrium-jonerna neutraliserad med en stark syra som saltsyra (HCl) så blir saltet neutralt (som koksalt).
Men det går fortfarande inte rena fram ren NaOH ur soda hur mycket man än försöker då när man torkar/kristallicerar ut lösningen så försvinner hydroxid-jonerna då de bara finns som vattenlösning tillsammas med löst natriumkarbonat/bikarbonat...
Men problemet med sodalösning i hur koncentrerad man än gör det så får man inte samma höga pH som överträffas lätt med NaOH löst i vatten även i rätt liten dos.
Med natriumvätekarbonat kommer man inte mycket högre än lite över pH 10 när man har mättad lösning, med natriumsoda i mättad lösning kommer man inte mycket över pH 12 (12.3 ?) - det räcker med knappt 1 gram NaOH i en liter vatten för att nå samma pH som mättad lösning av natriumsoda i pH (har dock inte kontrollräknat)
Vill man ha pH 12.4 och högre, kan man inte använda ovanstående sodalösning även om de är så mycket att en del av sodan fortfarande är olöst i lösningen. För att nå pH 13 räcker det med 4 gram NaOH i en liter vatten, för pH 14 så räcker det med 40 gram NaOH per liter vatten (ger 1 mol OH⁻ per liter) och med 400 gram löst per liter volym så når man runt pH 15 (10 mol OH⁻/liter).
Därav kan man använda utväxlingstekniken med bränd och släkt kalk (CaOH) då karbonatjonerna förenar sig med kalciumet väldigt hårt och fälls ut som kalk/krita och hydroxidjonerna från släkta kalket blir kvar i lösning för natriumjonerna (eller kaliumjonerna om man använder pottaska (kaliumkarbonat)) och pH ökar. Filtrerar man bort fällningen och industar lösningen så blir det till sist fast natriumhydroxid (kaliumhydroxid) på samma sätt som pulvret man köper i affären.
Redigerat:
Klicka här för att svara
Produkter som diskuteras i tråden
Liknande trådar
-
KI spår 2.25 % styrränta före sommaren 2025
Priser, Kalkyler, Fastighetsskatt m m. -
Nibe F2025 motorskyddet löser ut när värmepumpen ska stanna
Värmepumpar -
Nibe F2025-10 stannar med felkod 07 (motorskydd)
Värmepumpar -
15 år gammal Nibe F2025 nåt att ha?
Värmepumpar -
Akrylatfärg förbjuds i sommar
Artikelkommentarer